(文章转载自EurekAlert!,首次刊登于2021年9月7日)
香港科技大学(科大)及香港理工大学(理大)研究人员开发了体外囊泡重组实验,并通过结合该实验途径及定量质谱分析,发现了囊泡中受特定因子调控被装入囊泡的特定货物蛋白,和介导囊泡运输的新的调控蛋白。该研究成果及实验途径,为进一步揭示分泌途径相关的分子机制提供了重要的新工具。
真核细胞的分泌转运途径是一个非常重要的过程。人体内的很多生长因子,荷尔蒙以及其他重要的因子都是通过分泌转运途径从细胞中分泌出来,从而履行它们的生理功能。另外很多新合成的蛋白必须通过分泌转运途径以被运输到特定的亚细胞目标位点才能行使其功能。在分泌转运途径中承载货物蛋白的运输工具是运输囊泡。就像日常生活中的物流及运输服务,货物蛋白是否能够被运输到正确的靶向位点,关键在于这些货物蛋白是否被准确分选到特定的运输囊泡中。若货物蛋白分选功能缺失,会导致细胞极性建立、免疫功能以及其他生理功能缺陷。
在分泌途径中,调控蛋白质分选的关键参与者包括Arf家族蛋白和货物适配蛋白(cargo adaptor)。 Arf家族蛋白有20多个成员并且分别定位在特定的亚细胞位点。它们在结合GDP的不活跃状态和结合GTP的活跃状态之间循环。结合GTP的Arf 蛋白将胞质中各种货物适配蛋白招募到细胞膜或特定细胞器的膜上,一旦被招募到膜上,这些货物适配蛋白就会识别货物蛋白上的分选信号序列,将货物蛋白包装进入囊泡,实现蛋白质的分选。
尽管我们了解了货物分选的基本步骤原理,但受特定Arf家族成员或特定的货物适配蛋白调控的货物蛋白谱在很大程度上仍未得到充分研究。另外,我们也需要系统的实验途径以发掘及鉴定被特定的Arf蛋白招募到膜上的胞质蛋白。
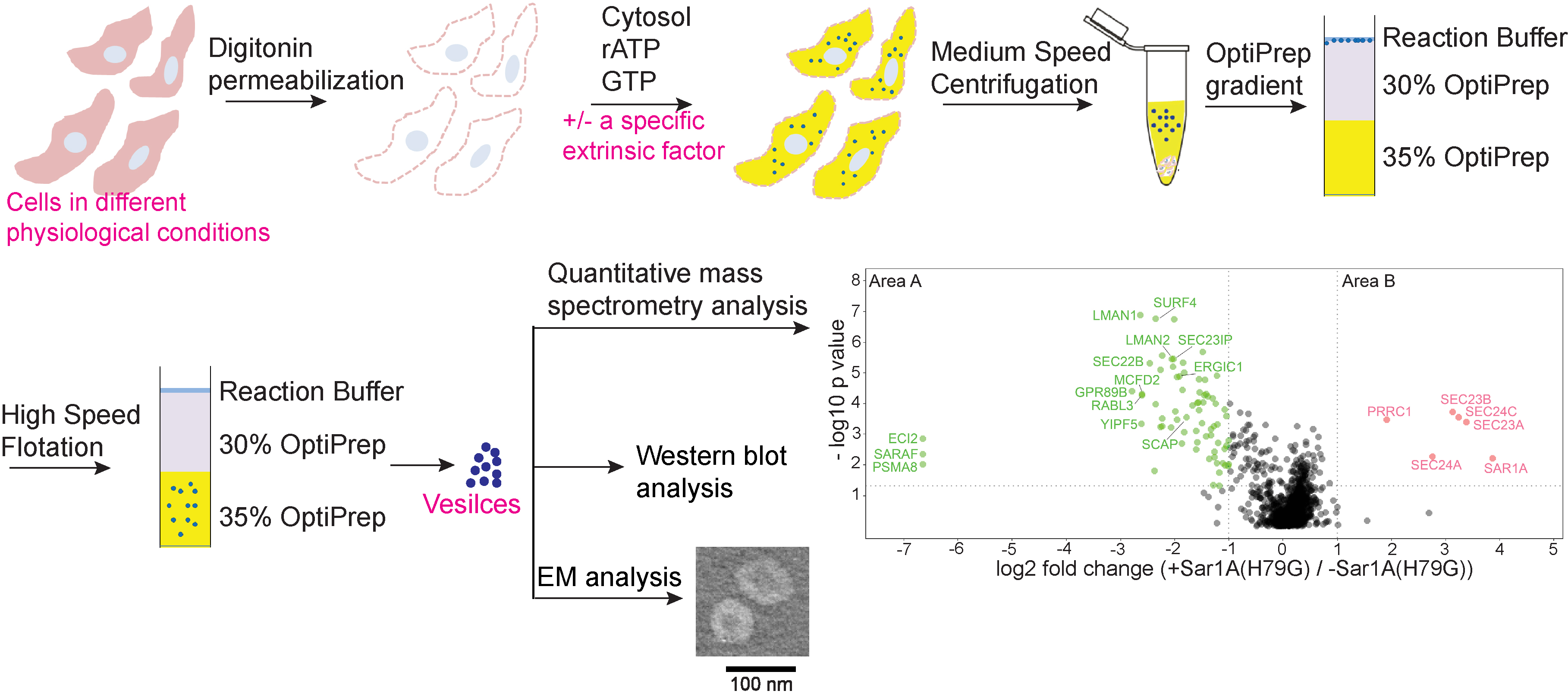
在本项研究中,科大生命科学部副教授郭玉松的团队利用体外囊泡重组实验重构了将货物蛋白包装进囊泡的过程,并且通过生化的方法分离了富集货物蛋白的囊泡。他们与理大姚钟平教授的研究团队合作,通过定量质谱分析分离的囊泡的蛋白质组学。该研究进一步系统地发现了依赖于GTP和囊泡膜结合的胞质蛋白,其中的一个重要胞质蛋白FAM84B与货物适配蛋白相互作用,并调节跨膜货物蛋白的运输。此外,该研究通过体外囊泡重组实验发现了依赖于GTP水解包装进囊泡的多个新型货物蛋白。
接下来,研究团队利用体外囊泡重组实验鉴定出了依赖于特定Arf家族蛋白 SAR1A调控从而被招募到囊泡上的胞质蛋白和货物蛋白。其中的一个胞质蛋白PRRC1会被招募到内质网出口位点,与COPII囊泡内壳蛋白相互作用,介导蛋白从内质网到高尔基体的运输。它的缺失会使COPII与囊泡膜的结合更为紧密从而影响正常运输过程。
通过这种方法,该研究还鉴定了COPII囊泡中的货物蛋白,其中包括两个货物受体蛋白SURF4和ERGIC53。团队随后用正常细胞和分别敲除了SURF4 或 ERGIC53 的细胞进行囊泡重组实验,鉴定了通过这两个货物受体蛋白所调控分选入囊泡中的特定货物蛋白。
这些结果表明,囊泡重组实验与定量质谱分析相结合是分析囊泡运输的有力手段,可以系统地揭示依赖于特定蛋白因子包装进囊泡中的货物蛋白,分析不同生理条件下囊泡中的蛋白组分,以及鉴定与囊泡膜上特定因子相互作用的胞质蛋白。
郭教授的研究重点之一是分泌途径中调控货物蛋白质分选入囊泡的分子机制,他和姚教授为本研究的共同通讯作者。科大博士后研究员黄艳博士、理大的殷海娣博士和香港中文大学的李白颖博士是这项研究的共同第一作者。科大的研究人员刘洋、唐笑、汪末和吴芷晓参与了这项研究。研究结果已获《美国国家科学院院刊》(Proceedings of the National Academy of Sciences)刊载。